CHIMIE
constitution de la matière – cliquer ici
les états de la matière-cliquer ici
à l’échelle macroscopique-cliquer ici
La matière existe principalement sous trois états : l’état solide, l’état liquide et l’état de gaz.
Cliquer ici pour plus de détails
à l’échelle microscopique-cliquer ici
La matière est constituée d’atomes, qui peuvent se regroupés en molécules. Un atome ou un groupe d’atomes peuvent se transformés en ions (particules chargées).
La disposition des molécules change selon l’état de la matière mais les molécules restent les mêmes.
Cliquer ici pour plus de détails
exercices interactifs
les changements d’état-cliquer ici
– solidification = passage d’un état liquide à un état solide.
– fusion = passage d’un état solide à un état liquide.
– liquéfaction = passage d’un état gazeux à un état liquide.
– vaporisation = passage de l’état liquide à un état gazeux.
Pour plus de détails, cliquer ici
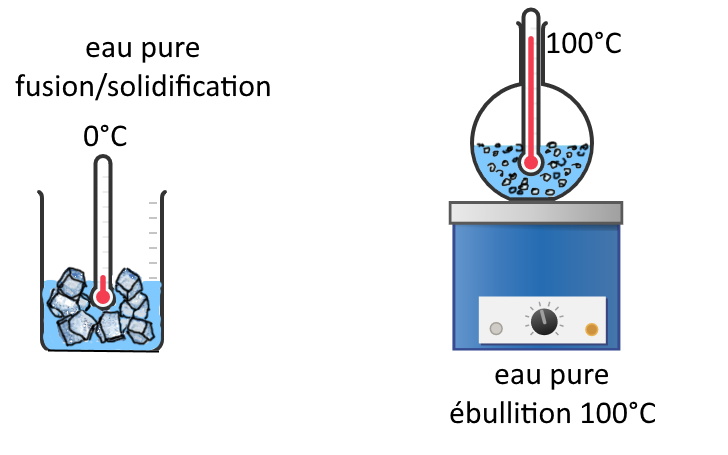
CORPS PUR : Lors d’un changement d’état d’un corps pur, on observe un palier de température sur la courbe des variations de la température en fonction du temps : la température reste la même pendant toute la durée du changement d’état.
Pour plus de détails, cliquer ici (lien identique au précédent)
Les températures de changement d’état sont caractéristiques d’un corps pur. Par exemple, l’eau pure se solidifie/la glace fond à 0°C et l’eau pure bout à 100°C, à pression normale.
Pour plus de détails, cliquer ici (lien identique au précédent)
Lors d’un changement d’état, la masse ne change pas (il y a toujours autant de molécules) mais le volume peut changer (les molécules se disposent autrement)
Pour plus de détails, cliquer ici (lien identique au précédent)
identifier des espèces chimiques – cliquer ici
les tests de reconnaissances – cliquer ici
Il existe des tests de reconnaissances qui permettent d’identifier certaines espèces chimiques, basé sur les propriétés chimiques de ces espèces chimiques.
En règle général, un réactif spécifique (ou détecteur) est ajouté à la substance inconnue :
– si la substance réagit, le test est positif et la substance est identifiée.
– si la substance ne réagit pas, le test est négatif et la substance n’est pas identifiée. Il faut faire un autre test pour l’identifier.
Les tests de reconnaissance peuvent être trouvés dans des documents de référence. Il n’est pas nécessaire de les apprendre par cœur mais on retrouve souvent les mêmes tests et donc les connaître permet de gagner du temps.
Chaque test (détecteur + résultats) est caractéristique d’une seule espèce chimique : on ne peut identifier (ou pas) qu’une seule espèce chimique par test.
Il existe deux manières d’utiliser ces tests :
– On veut savoir si une espèce chimique est présente d’un milieu : on réalise le test spécifique à cette espèce chimique. (exemple : on veut savoir s’il y a de l’eau dans une pomme, on réalise le test de reconnaissance de l’eau sur la pomme)
– on est en présence d’une espèce chimique inconnue que l’on veut identifier : on réalise plusieurs tests pour voir si l’un de ceux-là est positif. (exemple, on veut identifier un gaz inconnu, on peut réaliser les tests de reconnaissance du dioxygène, du dioxyde de carbone, du dihydrogène…)
les propriétés physiques des matériaux – cliquer ici
Un corps pur possède plusieurs caractéristiques physiques qui permettent de le reconnaître (sa couleur, sa dureté, sa conductivité thermique ou électrique…).
Le fer est par exemple le seul métal qui est attiré par un aimant.
on peut citer en particulier les températures de changement d’état et la masse volumique
Lors d’un changement d’état d’un corps pur, la température reste stable.
par exemple : l’eau bout à 100°C alors que l’éthanol bout à 78 °C.
Le fer fond à 1538°C alors que l’aluminium fond à 660°C.
La masse volumique est caractéristique d’un corps pur.
par exemple : la masse volumique de l’eau est de 1 g/cm3 alors que l’huile d’olive a une masse volumique de 0,916 g/cm3
On calcule la masse volumique d’une substance en divisant la masse (m) par son volume (V).
Son unité dans le système international (S.I) est le kilogramme par mètre cube ( kg/m3) mais on peut aussi le trouver en g/cm3.
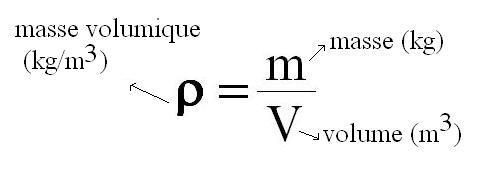
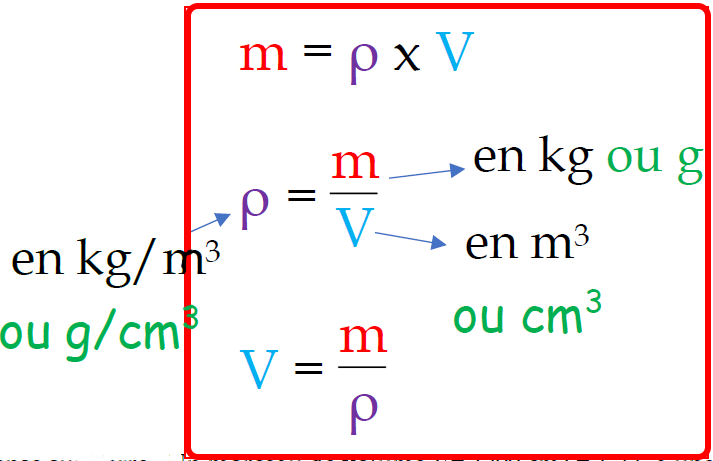
Mesure d’acidité – cliquer ici
On peut caractériser l’acidité d’une solution en mesurant son pH.
Cela ne permet pas d’identifier précisément le nom de la substance mais donne des indications, notamment sur la présence d’ions hydrogène H+ ou d’ions hydroxyde OH–.
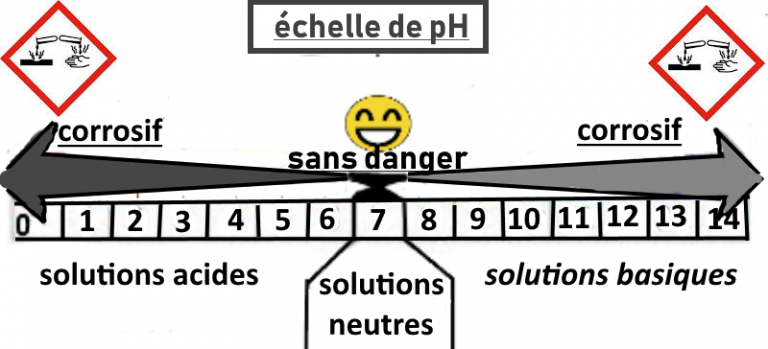
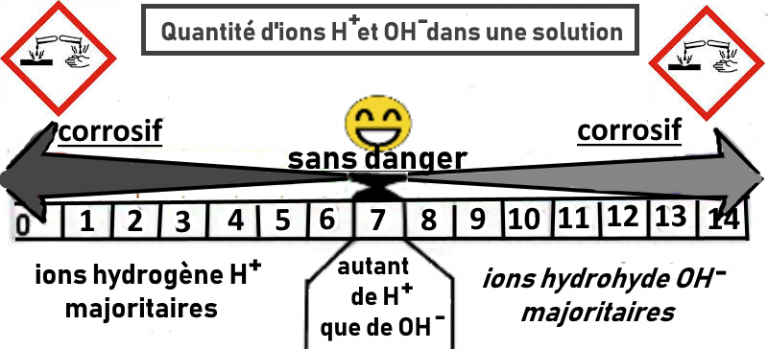
Une solution acide concentrée ou une solution basique concentrée sont corrosives. Il faut les manipuler avec attention.
les mélanges – cliquer ici
le vocabulaire des mélanges
Un corps pur n’est constitué que d’un type de molécules.
un mélange est constitué de plusieurs types de molécules
Un mélange peut être homogène (on ne distingue pas les différents constituants = »on n’a pas l’impression que c’est un mélange en le regardant, comme le lait ») ou hétérogène (on distingue les différents constituants = »on voit du premier coup d’œil qu’il y a plusieurs substances dedans »)
Si on mélange deux liquides ensemble, ils peuvent former :
– un mélange hétérogène, alors on dit qu’ils sont non-miscibles. Le liquide le moins dense flotte sur le liquide le plus dense.
– un mélange homogène, alors on dit qu’ils sont miscibles.
Si on mélange un solide et un liquide, ils peuvent former :
– un mélange hétérogène, alors on dit que le solide est insoluble dans le liquide (il ne se dissout pas)
– un mélange homogène, alors on dit que le solide est soluble dans le liquide.
Dans ce cas, le solide dissout est appelé le soluté et le liquide est appelé le solvant. Le mélange homogène est appelée la solution.
Il existe une masse maximale de soluté que l’on peut dissoudre dans le solvant : c’est la solubilité du soluté dans le solvant (en gramme par litre de solution). Quand on dépasse la solubilité, alors la solution est saturée et une partie du soluté ne se dissout plus.
Lors d’un mélange comme une dissolution, la masse ne change pas (le nombre de molécules est le même avant et après le mélange) :
masse (solution) = masse (soluté) + masse(solvant)
Pour plus de détails, cliquer ici
l’air, un mélange gazeux
dissolution d’un gaz dans l’eau
en construction
solubilité d’une substance
en construction
Transformations chimiques – cliquer ici
les combustions -cliquer ici
les transformations acide-base – cliquer ici
les transformations acide-métaux – cliquer ici
organisation de la matière dans l’Univers – cliquer ici
la formation de l’Univers – cliquer ici
les particules de la matière – cliquer ici
MECANIQUE
étude d’un mouvement – cliquer ici
référentiel – cliquer ici
Un référentiel est un lieu ou un objet par rapport auquel on étudie le mouvement d’un objet.
Le mouvement d’un objet dépend du référentiel choisi.
Cliquer ici pour plus de détails
En règle générale, on choisit le sol comme référentiel pour un mouvement sur Terre (mouvement d’une voiture, d’une personne…)
En règle générale, on choisit le Soleil comme référentiel pour un mouvement dans le système solaire (mouvement des planètes, des comètes…)
trajectoire et vitesse – cliquer ici
Un mouvement peut être décrit par sa trajectoire et par sa vitesse.
La trajectoire d’un point est l’ensemble des positions prises par ce point au cours du temps. (elle dépend du référentiel)
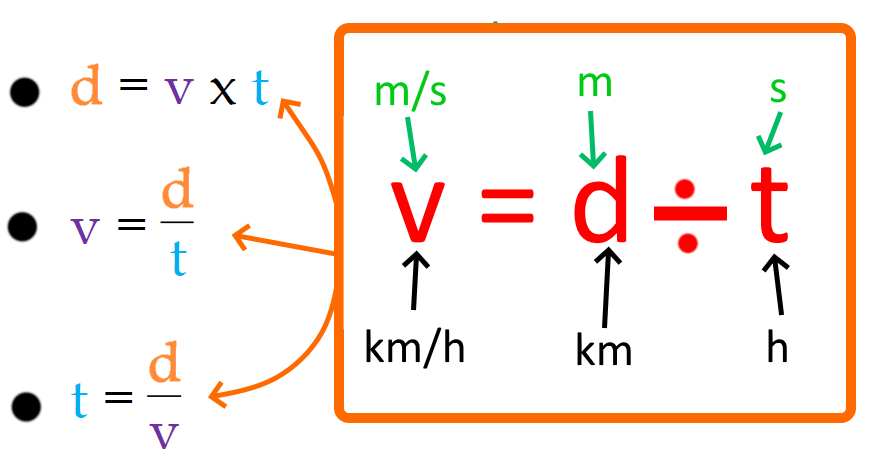
Dans le cas d’un mouvement uniforme, la vitesse de l’objet, la distance parcourue et la durée du trajet sont reliés par la relation v = d/t avec
– v = vitesse en mètre par seconde (m/s)
– d = distance parcourue en mètre (m)
– t = durée du trajet en seconde (s)
Sur un schéma, on représente la vitesse par une flèche qui a le même sens que le mouvement, dont la longueur est proportionnelle à la valeur de la vitesse et dont la direction est tangente à la trajectoire.
énergie cinétique d’un objet en mouvement
L’énergie cinétique est l’énergie d’un objet en mouvement. Elle se note Ec et s’exprime en joules (J).
L’énergie cinétique est proportionnelle à la masse de l’objet et au carré de la vitesse
On peut calculer l’énergie cinétique d’un objet à l’aide de la relation suivante, sachant que Ec représente l’énergie cinétique en joules, m représente la masse en kilogramme et v la vitesse en mètres par seconde.
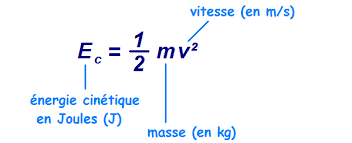
étude d’une interaction
forces et interactions
types d’action et effet d’une action sur un objet
Il y a action mécanique lorsqu’un objet, appelé acteur, agit sur un autre objet, appelé receveur.
Il existe 2 types d’actions mécaniques :
– Les actions de contact : les deux objets (acteur et receveur) doivent se toucher pour que l’action puisse exister
– Les actions à distances: les deux objets (acteur et receveur) n’ont pas besoin de se toucher pour que l’action existe.
On va plutôt parler d’interaction entre deux objets car lorsqu’un objet agit sur un autre, celui-ci agit aussi sur le premier objet.
Les effets d’une action mécanique sur un objet peuvent être :
– déformer cet objet
– mettre cet objet en mouvement
– Modifier le mouvement de l’objet (changer sa vitesse ou sa trajectoire)
modélisation d’une interaction par une force
Une action est modélisée par une force
Une force est définie par 4 caractéristiques :
– sa direction (verticale, horizontale, oblique, droite (AB)….) : la direction est une droite.
– Son sens (vers la droite, vers le haut, vers le bas, vers le point A) : pour chaque direction, il existe deux sens.
– Son point d’application : soit l’endroit de contact entre les deux objets pour une action de contact, soit son centre de gravité pour une action à distance ou une action de contact répartie sur toute la surface de l’objet.
– Sa valeur (ou intensité) : elle se mesure avec un dynamomètre (appareil de mesure) et s’exprime en newton (N).
Une force est notée selon le modèle suivant : Facteur / receveur
Une force est représentée par une flèche dont la longueur est proportionnelle à la valeur de la force, de même direction et sens que la force, et qui commence au point d’application de la force.
des exercices interactifs
le cas particulier du poids d’un objet
la gravitation universelle
ENERGIE ET ELECTRICITE – en cours d’élaboration
LES SIGNAUX sonores et lumineux – en cours d’élaboration




