Pour commencer, une animation de la cité des sciences pour expliquer la différence entre température et chaleur.
Un changement d’état est le passage d’un état à un autre.
– solidification = passage d’un état liquide à un état solide.
– fusion = passage d’un état solide à un état liquide.
– liquéfaction = passage d’un état gazeux à un état liquide.
– vaporisation = passage de l’état liquide à un état gazeux.
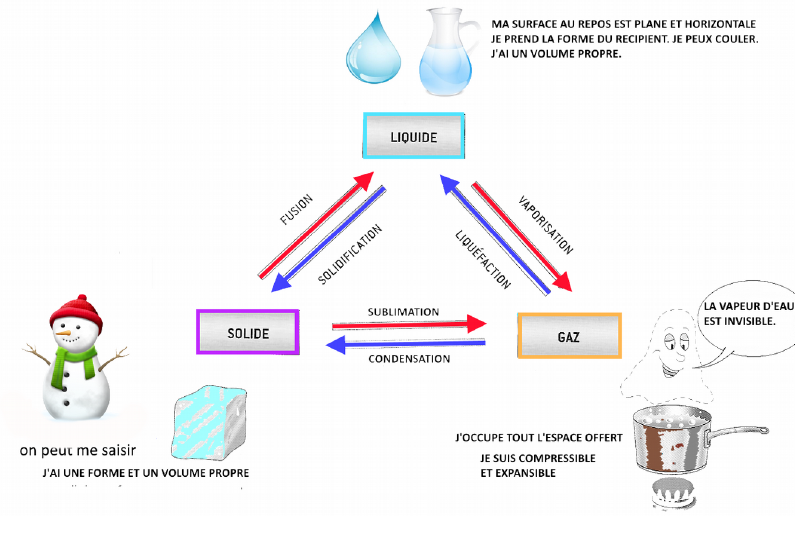
Lors d’une solidification ou d’une liquéfaction, la substance cède de l’énergie au milieu qui l’entoure : on refroidit la substance.
Lors d’une fusion ou d’une vaporisation, la substance reçoit de l’énergie du milieu qui l’entoure : on chauffe la substance.




