les variations de la masse et du volume lors d’un changement d’état
Lors d’un changement d’état, la masse ne change pas (il y a toujours autant de molécules) mais le volume peut changer (les molécules se disposent autrement)
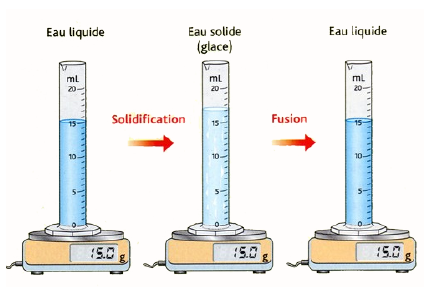
Dans le cas de l’eau, la glace occupe un volume plus grand que l’eau liquide.
En effet, le nombre de molécules reste le même lorsqu’on fait chauffer ou que l’on refroidit de l’eau : la masse dépend du nombre de molécules donc comme celui ne change pas , la masse reste la même.
Par contre, les molécules ne sont pas disposées de la même façon dans un solide, dans un liquide ou dans un gaz donc le volume va changer selon que les molécules sont plus serrées ou moins serrées.
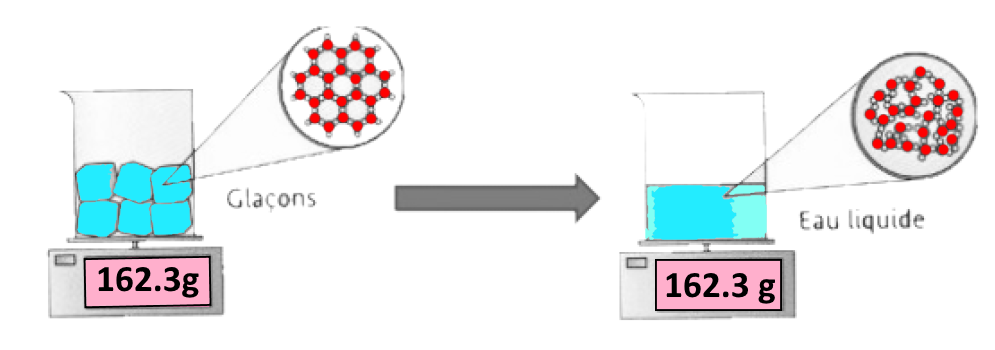
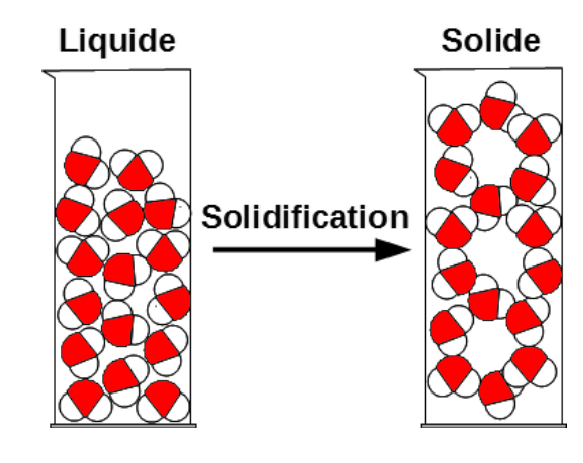
Dans le cas de l’eau, les molécules d’eau dans de la glace solide forment des sortes d’hexagone, ce qui prend plus de place que dans un l’eau liquide où les molécules roulent les unes sur les autres.
Deux manipulations à faire chez soi pour expliquer deux phénomènes naturels :
Pourquoi les canalisations d’eau non protégées peuvent éclater en hiver sous le gel ?
- remplir un verre à raz bord d’eau
- le mettre au congélateur
- observer la surface de la glace une fois l’eau entièrement solidifiée.

Le niveau des océans va-t-il augmenter si la banquise fond ?
Pour rappel : la banquise est constituée de glace flottant sur l’eau. Il faut bien faire la différence avec les glaciers ou la calotte glacière du pôle sud qui eux sont constitués de glace posée sur un sol.
- Mettre des glaçons dans un verre, posé sur une assiette.
- rajouter de l’eau à raz bord.
- laisser fondre entièrement les glaçons.
- Observer la quantité d’eau dans l’assiette et le niveau de l’eau dans le verre. Comparer avec le début de l’expérience.





