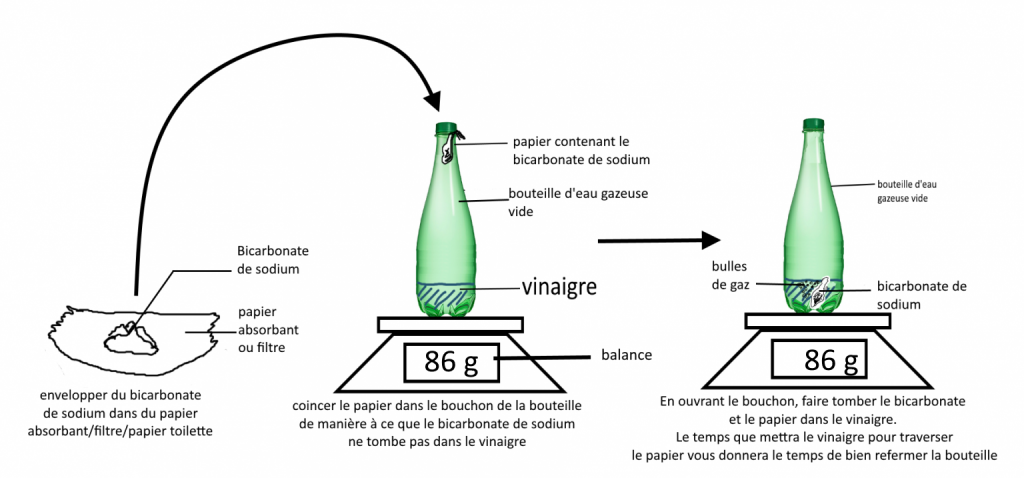
Question 1 : Pourquoi peut-on dire qu’il y a eu une transformation chimique lors de cette expérience ?
Il y a transformation chimique lorsque des substances disparaissent et que de nouvelles substances apparaissent or ici, on observe la formation d’un gaz et la disparition du solide : il s’agit bien d’une transformation chimique.
les réponses justes mais pas très précises :
– …car il y a eu changement de coloration (il faut dans ce cas, préciser les couleurs…De plus, un changement de couleur est un bon indice mais cela ne suffit pas toujours).
– …Car le résultat n’est pas le même qu’au début de l’expérience. (le mot « résultat » doit être remplacé par le mot « substances » et il faut indiquer précisément en quoi elles sont différentes en se servant des observations)
– ...car il y a une réaction entre les deux composants (il y a transformation car il y a réaction : rien n’est vraiment expliquer –> il faut donner des preuves en se basant sur les observations)
Les réponses qui ne sont pas vraiment fausses dans l’absolu mais que l’on n’a pas vérifié dans l’expérience:
– car tous les atomes de réactifs se retrouvent dans les atomes de produits. (on ne l’a pas vérifié dans l’expérience car les atomes ne sont pas visibles)
Les réponses qui sont fausses!
…Car c’est toujours les mêmes molécules. (Attention, cela ressemble à une confusion entre atomes et molécules…Ici, justement les molécules changent)
…car les produits des réactifs sont restés les mêmes dans les produits .(confusion dans les mots de vocabulaire. Que veut dire ce « produit des réactifs ? »)
…car le bicarbonate de sodium s’est transformé en gaz, (ça, c’est plutôt bien) il s’est condensé, (ça, non! Un gaz peut se condenser en liquide mais un liquide se vaporise…Dans les deux cas, il s’agit d’un changement d’état et donc d’une transformation physique car la substance est toujours la même. Le vocabulaire employé n’est pas le bon.)
….car le morceau de craie s’est dissout. (la dissolution n’est pas une transformation chimique : lors d’une dissolution, le solide se disperse dans le liquide mais il est toujours là –> si on fait évaporer le liquide, on pourrait retrouver le solide, ce qui n’est pas le cas ici. La craie disparait car elle se transforme en autre chose)
Question 2 : le gaz qui se forme lors de cette expérience trouble l’eau de chaux. Quel est ce gaz ?
Puisque le gaz a troublé l’eau de chaux, le gaz est du dioxyde de carbone (CO2).
Vous commencez à bien connaître ce test! Si vous vous êtes trompé, il faut revoir le principe ICI avec le corrigé ICI
Question 3 : Pourquoi faut-il faire attention de bien fermer la bouteille ?
Bien évidemment, comme à chaque fois que l’on travaille avec un gaz, il faut l’empêcher de s’échapper! Rappelons qu’un gaz se disperse dans tout l’espace offert!
…et si le gaz s’échappe, on ne pourrait pas vérifier si la masse est la même ou pas…
La question ne portait pas sur le flacon d’acide mais je comprends que certains l’ont cru.
Pour ceux qui ont parlé de sécurité, soyez précis : dire, il faut fermer la bouteille par sécurité ne suffit pas –> il faut fermer le flacon d’acide chlorhydrique car il est corrosif et on pourrait se brûler les doigts ou les yeux.
Par contre, l’acide chlorhydrique n’est pas inflammable…De plus, s’il était inflammable, la première des précautions est de ne pas approcher de flamme.
Question 4 : Que peut-on dire de la masse lors d’une transformation chimique ?
On peut dire que la masse est la même du début à la fin de l’expérience, cela ne change rien.
Pour justifier, donner des valeurs :
-(réaction maison) Avant la transformation chimique, la masse était de 313g et ( 300 g de vinaigre blanc et 13 g de bicarbonate) et après l’expérience cette masse est identique.
– (pour la vidéo) : Les 2 masses sont les mêmes( 86 g)
Quand on fait une expérience, on se base d’abord sur les résultats de l’expérience donc cette réponse, si elle est correcte en théorie n’est pas bonne car elle ne se sert par de l’expérience pour la justification :
Lors d’une transformation chimique la masse reste la même car les atomes présents dans les réactifs sont tous allés dans les produits
Question 5 : Une balance de physique du collège a une précision de 0,2 g. Une balance de cuisine a une précision de 2g. Sachant qu’un litre de dioxyde de carbone pèse environ 1.9g. Les résultats obtenus si vous faites l’expérience chez vous sont ils valides ?
bonnes réponses :
– Non, les résultats obtenus ne sont pas valides car le dioxyde de carbone pèse moins lourd que la précision de la balance de cuisine .
– Pas forcément, étant donné que dans une bouteille de 1 litre, la balance de cuisine et ses 2 g de précision pourraient très bien ne pas détecter le dioxyde de carbone.
– Non car le poids la masse de dioxyde de carbone est inférieure à la précision de la balance de cuisine
Les réponses fausses ou confuses :
– Non car si on fait à la maison c’est entre 0 et 3,9 g que au collège c’est entre 1,7 et 2,1 g. ????il faut développer ta réponse : si la masse mesurée est de 2g, la balance de la cuisine peut afficher un chiffre entre 0 et 3.9g (+ ou – 2g) alors qu’au collège, elle affichera une valeur entre 1.7 et 2.1 g. On pourrait alors croire, en cuisine que la masse a augmenté alors que ce n’est pas vrai.
– Oui parce que si le dioxyde de carbone fait 1,96g ça veut dire 2g. Pas très clair, je ne suis pas sûre de comprendre ce que tu veux dire…
– Non car se sont pas les mêmes grammes. un gramme est toujours un gramme. Ce que tu veux dire est que ce n’est pas la même précision..mais dans ce cas, tu n’expliques par pourquoi c’est embêtant.
– non car la balance va rajouté 2g a l’expérience
– Oui car il y a juste une différence de 0.1
– Les résultats sont valides car sur notre balance nous allons obtenir 2g
–> la précision d’un appareil de mesure indique l’erreur qu’il peut faire en mesurant donc une précision de 2g indique qu’il peut indiquer la « vraie »mesure mais en enlevant ou en ajoutant jusqu’à 2g. Mesurer une masse inférieure à 2g avec cette balance n’a pas de sens car on ne pourra pas savoir s’il s’agit de la « vraie » masse ou de l’erreur commise par la balance.
Question 6 : On fait brûler 32g de laine de fer dans une coupelle posée sur une balance. Lors de cette combustion, le fer réagit avec le dioxygène de l’air pour former de l’oxyde de fer. A la fin de la combustion, la balance indique 44g. Quelle est la masse de dioxygène qui a réagit ? Justifie ta réponse.
Lors d’une transformation chimique, la masse ne change pas (masse réactifs = masse produits) or la masse totale à la fin de la combustion est de 44g (= masse produits) et la masse de la laine de fer au début est de 32g.
Pour trouver la masse de dioxygène, il faut effectuer la masse totale- la masse de laine : 44-32=12g.
La laine de fer a réagit avec 12 g de dioxygène.
ATTENTION! ATTENTION! ATTENTION!
Le poids = attraction terrestre
ICI, il FAUT utiliser le mot « MASSE«




