Activité 2 : espèces chimiques atomiques, moléculaires et ioniques
Notion d’espèces chimiques – besoins des plantes – analyse du sol de Mars
A retenir livret p9 et 13
Un élément chimique est une « brique » de la matière : son symbole se trouve dans le tableau périodique des éléments. Il est défini par son nombre de protons.
Une espèce chimique est composée de particules identiques. On distingue :
Les espèces chimiques neutres (leur charge électrique est nulle)
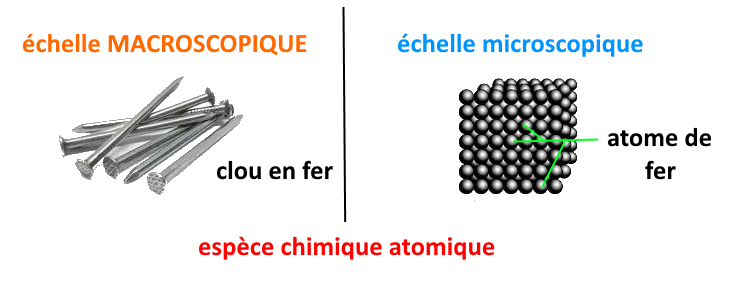
les espèces chimiques atomiques : elles ne contiennent que des atomes identiques et leur formule ne contient que le symbole de l’atome.
ex : le fer, de formule Fe ; le magnésium, de formule Mg
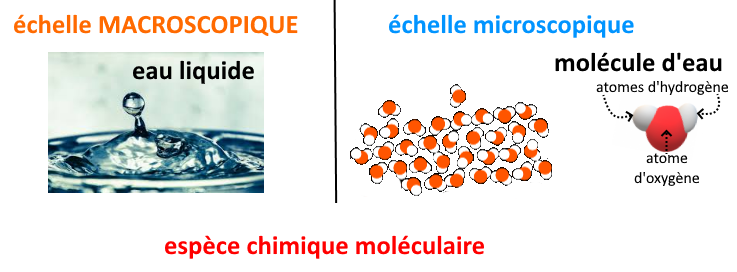
Les espèces chimiques moléculaires : elles ne contiennent que des molécules identiques. Leur formule indique la constitution de la molécule.
Ex : l’eau, de formule H2O ; le diazote, de formule N2
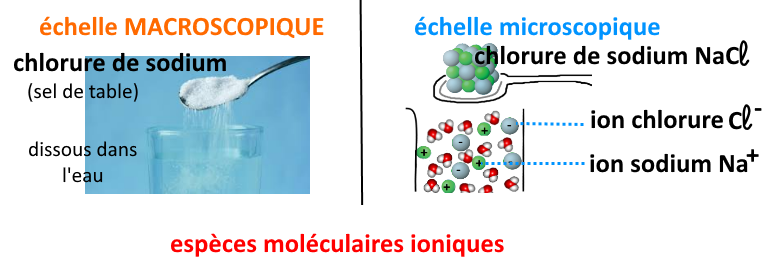
Les espèces chimiques électriquement chargées :
A retenir livret p 16
Les espèces chimiques ioniques : elles ne contiennent que des ions positifs ou négatifs. Leur formule indique la constitution de l’ion, ainsi que sa charge.
Ex : l’ion sodium Na+ ; l’ion chlorure Cl– ; l’ion cuivre II, de formule Cu2+ ; l’ion sulfate, de formule SO42-
Un ion positif est toujours associé à un ion négatif de manière à ce que la matière reste neutre. La formule chimique associe les ions positifs et négatifs en indiquant les proportions de chacun.
ex : sulfate de cuivre (Cu2++SO42- ) ; Chlorure de fer (Fe2+ + 2 Cl–)
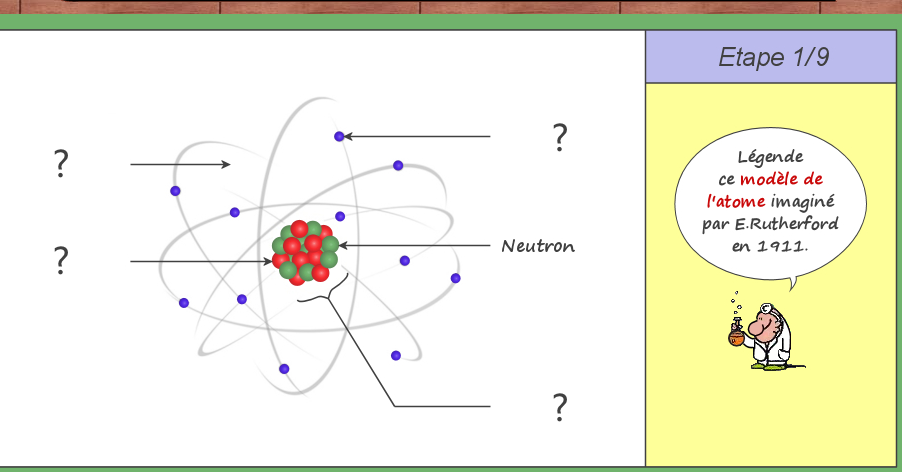
Exercice pour comprendre la transformation d’un atome en ion : cliquer sur l’image
Vidéo bilan
exercice interactif pour faire la différence entre éléments chimiques et espèces chimiques
exercices interactif pour identifier atomes, molécules ou ions
exercice interactif pour identifier les particules neutres, chargés positivement ou négativement
Pour aller plus loin et avoir plus d’explication, cliquer ici
Notion de pH – acidité du sol de Mars
A retenir livret p 18
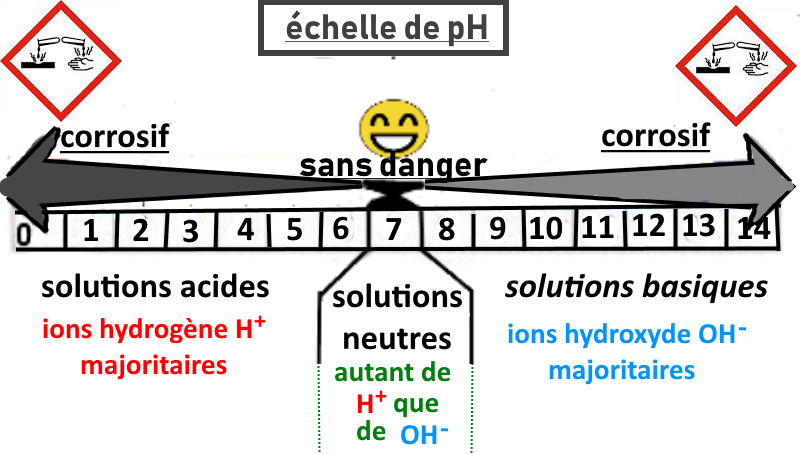
Le pH d’une solution indique le caractère acide, neutre ou basique de cette solution.
Le pH d’une solution est une grandeur sans unité, pouvant varier de 0 à 14.
Le degré d’acidité d’une solution dépend de la quantité d’ions hydrogène H+ et d’ions hydroxyde OH–qu’elle contient.
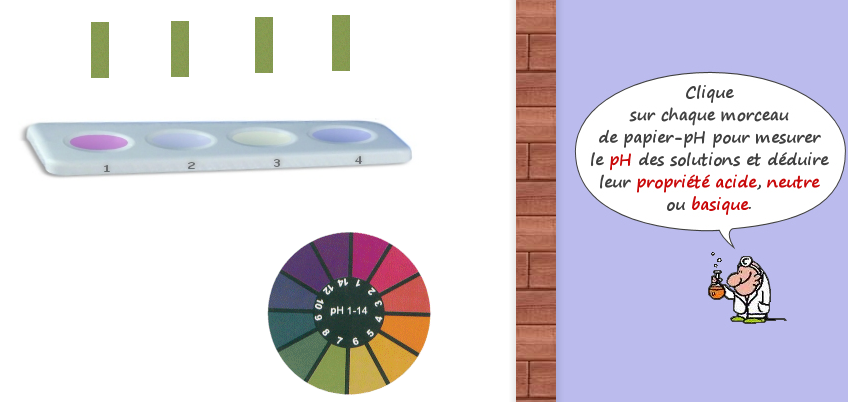
Une expérience interactive pour faire des mesures de pH : cliquer sur l’image
Notion de transformation chimique – formation de l’eau
A retenir livret p12 – p14 – p17
Une vidéo qui rappelle les notions vues en quatrième : conservation de la masse et modélisation d’une transformation chimique. Merci à Romain Bourdel-Chapuzot et à sa chaine youtube




