Exercice 2 : savoir utiliser les résultats d’un test de reconnaissance.
Exercice corrigé :
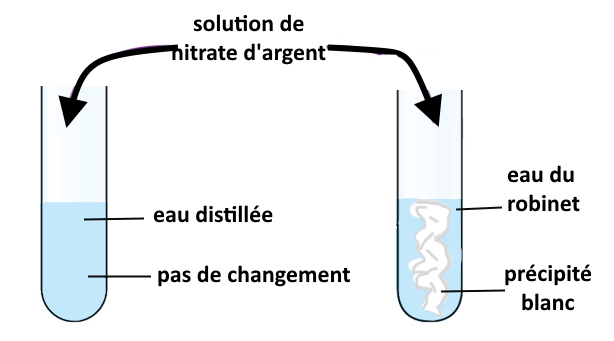
on a réalisé le test au nitrate d’argent avec de l’eau distillée et de l’eau du robinet (voir schéma)
Question 1 – que peut-on conclure des résultats des tests ? cliquer ici pour la correction
On observe la formation d’un précipité blanc lorsqu’on ajoute du nitrate d’argent dans l’eau du robinet mais pas lorsqu’on ajoute le nitrate dans l’eau distillée. Cela signifie que l’eau du robinet contient des ions chlorure mais que l’eau distillée n’en contient pas.
Question 2 – en se servant de ces résultats, indiquer pourquoi il est indispensable de bien rincer les tubes à essai avec de l’eau distillée avant de de réaliser un test. cliquer ici pour la correction
Il est donc indispensable de bien rincer les tubes à essai avec de l’eau distillée avant de faire un test : si on rince avec l’eau du robinet, le test pourra être positif à cause de l’eau du rinçage et pas parce que la solution testée contient des ions chlorure. Rincer à l’eau du robinet peut fausser les résultats du test.
Exercice : de l’eau minérale contient des ions calcium, des ions sodium, des ions magnésium, des ions chlorures, des ions sulfates et des ions hydrogénocarbonates. On réalise un test au nitrate d’argent et un test à la soude.
question 1 – quel sera le résultat du test au nitrate d’argent ? – cliquer ici pour la correction
le test au nitrate d’argent permet d’identifier les ions chlorure or l’étiquette indique que l’eau minérale testée contient des ions chlorure donc ce test sera positif.
Rq : Citer les sources ! indiquer où vous avez trouvé les indications –> dans l’étiquette.
question 2 – le test à la soude est négatif. Peut-on affirmer que l’eau ne contient aucun ion positif ? – cliquer ici pour la correction
Le test à la soude, qui permet d’identifier les ions fer II, fer III et les ions cuivre, sera négatif car l’étiquette n’indique pas que ces ions sont présents dans cette eau minérale.
Mais l’eau peut contenir de nombreux autres ions positifs qui ne sont pas reconnus par le détecteur « soude ».
pour info : les ions calcium, les ion sodium et les ions magnésium sont des ions positifs (cations)
Exercice corrigé :
on a réalisé un test de reconnaissance pour identifier des ions cuivre, fer II et fer III.
On obtient les résultats ci-contre

Question 1 –quel réactif de reconnaissance a-t-on utilisé pour réaliser ces tests et obtenir ces résultats ? cliquer ici pour la correction
Pour identifier les ions fer II, fer III et les ions cuivre, on utilise le même réactif de reconnaissance : l’hydroxyde de sodium (ou soude).
Question 2 – Indiquer quel ion a été mis en évidence pour chacun des tubes.
Dans le premier tube, le précipité est vert donc on a mis en évidence l’ion fer II, de formule Fe2+
Dans le deuxième tube, le précipité est rouille donc l’ion fer III, de formule Fe3+ est présent.
dans le troisième tube, le précipité est bleu donc on a mis en évidence l’ion cuivre, de formule Cu2+
Rq : bien préciser l’observation (couleur du précipité) pour justifier la réponse.




