principe général : « rien ne se perd, rien ne se crée, tout se transforme »
Une transformation chimique est une réorganisation des atomes présents dans les molécules des réactifs pour former les molécules des produits.
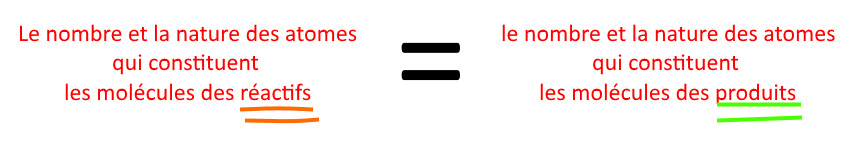
Une transformation n’est possible que si cette conservation des éléments est respectée. Il est donc essentiel de la vérifier quand on étudie une transformation.
Voici une méthode en 2 étapes pour vérifier la conservation des éléments et donc vérifier si la transformation est possible.
Pour réussir cette vérification, IL FAUT connaître la différence entre un atome et une molécule et savoir reconnaître le symbole d’un atome (ou élément chimique) → si ce n’est pas le cas, aller d’abord réviser ces notions : cliquer ici pour le cours, et cliquer ici pour des exercices interactifs.
Étape 1 : vérifier que l’on retrouve bien les mêmes éléments chez les réactifs et chez les produits.
Exemple 1 : on retrouve bien tous les atomes. (on retrouve les mêmes symboles à droite et à gauche de la flèche)
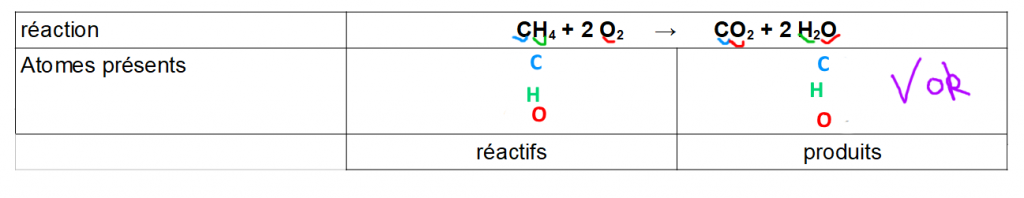
Exemple 2 : on ne retrouve pas les même atomes (le symbole C n’existe pas dans les produits et le symbole Ca n’existe pas dans les réactifs)→ transformation impossible.
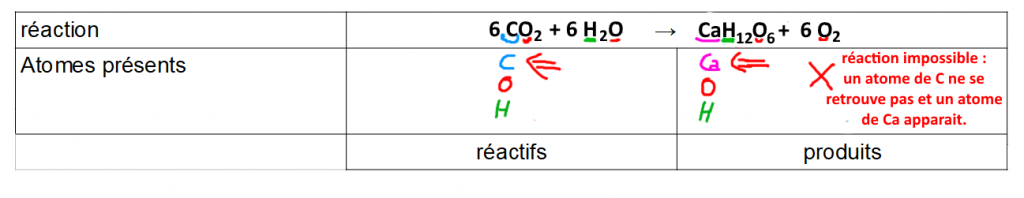
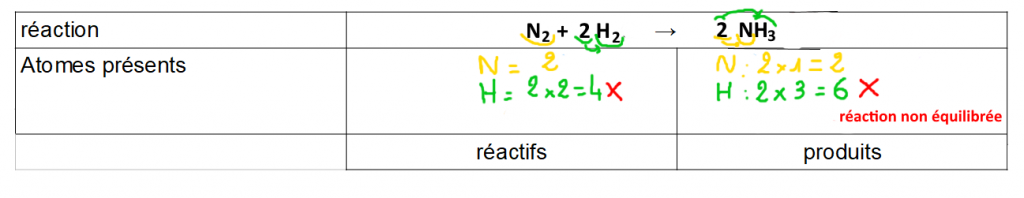
Étape 2 : vérifier que l’on retrouve bien le même nombre de chaque élément chez les réactifs et chez les produits.
Attention ! Bien tenir compte des coefficients devant les formules → ils indiquent le nombre de molécules donc s’il y a plusieurs molécules, le nombre d’atomes va aussi augmenter.
Exemple 1 : on retrouve bien tous les atomes en même nombre → la conservation des éléments est vérifiée, la transformation chimique peut se faire dans ces proportions.
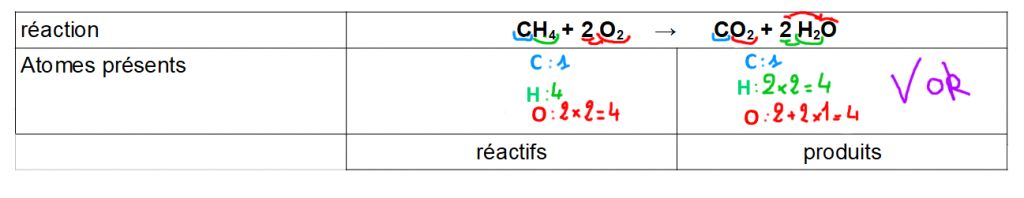
Le coefficient « 2 » s’applique à toute la molécule : 2 H2O signifie H2O + H2O donc il y a bien 4 atomes d’hydrogène H et 2 atomes d’oxygène O.
Exemple
2 :
les
atomes d’hydrogène H sont plus nombreux chez les produits que chez
les réactifs → la transformation est impossible avec ces
proportions.
A toi de jouer : exercices corrigés sur la page suivante




