Que se passe-t-il au niveau des molécules lorsque l’on fait brûler du carbone (du charbon) dans du dioxygène ?
Bien sûr, on peut simplifier en ne prenant que le nombre de molécules minimum qui réagissent : ici, une molécule de dioxygène et un atome de carbone.
on obtient alors un bilan de ce qui se passe au niveau des molécules : une molécule de dioxygène réagit avec un atome de carbone pour former une molécule de dioxygène. S’il faut de l’énergie pour activer la combustion, la transformation va dégager de l’énergie par la suite : ça chauffe!
on modélise cette transformation en écrivant l’équation de réaction : celle-ci contient les formules chimiques des réactifs et des produits ET les proportions dans lesquelles ils réagissent et se forment. C’est un peu comme une recette de cuisine où l’on aurait les ingrédients et les quantités qu’il faut
équation de réaction de la combustion du carbone :
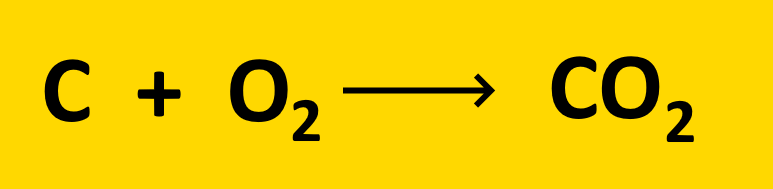
Dans la réalité, il n’y a pas toujours le nombre exact de molécules pour que toutes les molécules de réactifs disparaissent (rappel : un réactif est la substance qui existe au début de la transformation et qui réagit).
La transformation s’arrête lorsqu’un des réactifs a totalement disparu. On dit que l’autre réactif (celui qui n’a pas totalement disparu) est en excès.
Une courte vidéo pour faire le point sur ce qu’il faut comprendre de la combustion du carbone




