passage d’un ion à un atome (et vice versa)
On a vu qu’un atome est constitué d’un noyau central contenant des protons (charges positives) et des neutrons (charges nulles), entouré d’un nuage d’électrons (charges négatives) et qu’il est électriquement neutre car il contient autant de protons que d’électrons.
Le noyau d’un atome est stable et le nombre de protons détermine le nom de l’élément chimique, d’après la classification périodique des éléments.
Il arrive qu’un ou plusieurs électrons soit arrachés à un atome pour être transféré à un autre atome.
L’atome qui a perdu des électrons n’est plus neutre car il a désormais plus de protons que d’électrons : il devient un ion positif.
L’atome qui a récupéré des électrons n’est plus neutre car il a désormais plus d’électrons que de protons : il devient un ion négatif.
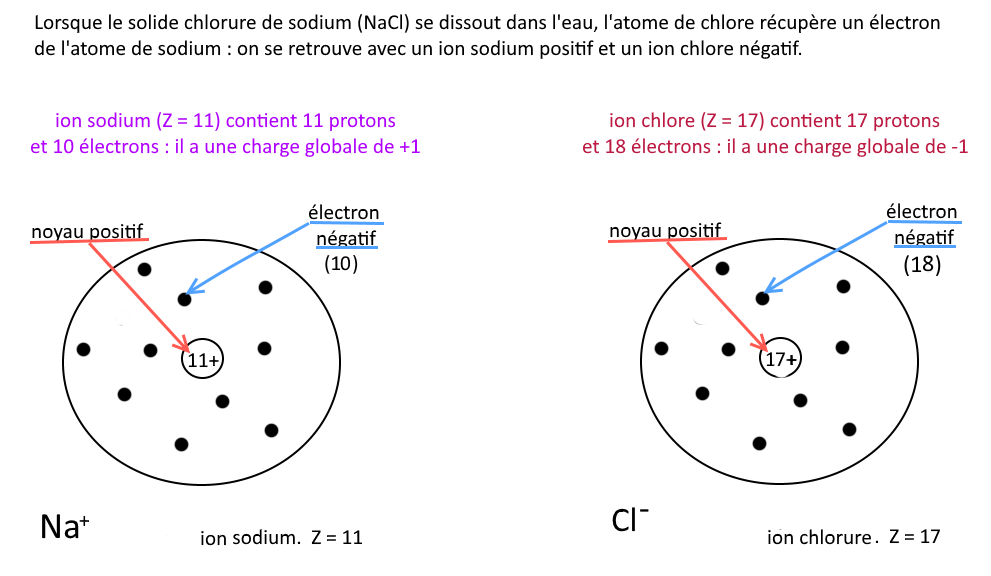
Un ion monoatomique provient d’un atome qui a perdu ou gagné un ou plusieurs électrons.
Un ion monoatomique est constitué :
– du même noyau que l’atome correspondant.
– d’un nuage électronique avec un nombre différent d’électrons par rapport à l’atome.
De manière plus générale : un ion provient d’un atome ou d’un groupe d’atomes ayant perdu ou gagné un ou plusieurs électrons.
L’ion est positif s’il a un défaut d’électrons (moins d’électrons que de protons)
L’ion est négatif s’il a un excès d’électrons (plus d’électrons que de protons)
Lors d’une transformation chimique ou d’une dissolution, un atome peut donc se transformer en ion mais l’inverse est aussi vrai : un ion peut devenir un atome
Dans cette vidéo par exemple, on plonge du cuivre atomique (le sapin) dans une solution ionique contenant des ions argents : les ions argent se transforment en atomes d’argent qui se déposent sur le sapin tandis que les atomes de cuivre vont se transformer en ion cuivre qui donnent une coloration bleue au liquide!
Exercices interactifs :
un lien sur le site de l’académie pour passer d’un atome à un ion : ici
Cet exercice permet de s’entraîner à différencier un atome d’un ion en observant leur constitution (protons, neutrons et électrons)