Les particules qui interagissent lors des transformations chimiques ne sont pas visibles à l’œil nu. On a recours à une modélisation pour représenter ce qui se passe et étudier les transformations.
activité 1 : les notions de bases pour étudier les transformations chimiques au niveau moléculaire- 1ère partie
Une substance qui n’est constituée que d’une seule espèce chimique est appelée un corps pur.
Un corps pur n’est constitué que d’un seul type d’espèces chimiques, comme les molécules. par exemple, l’eau est un corps pur constitué uniquement de molécules d’eau.
Une molécule est constituée d’atomes liés entre eux. Sa formule chimique indique sa composition (nombre et type d’atomes)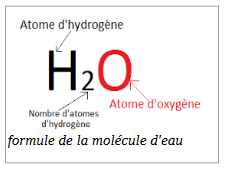
voir la fiche bilan sur les atomes et les molécules
s’entraîner sur les formules chimiques
Les atomes sont les constituants de la matière. Leurs symboles sont répertoriés dans la classification périodique de Mendeleiev.
Il y a transformation chimique lorsque des substances disparaissent (on les appelle les réactifs) alors que de nouvelles substances apparaissent (on les appelle les produits).
Au niveau nanoscopique (à l’échelle des atomes et des molécules), il y a transformation chimique lorsque les molécules changent alors que dans une transformation physique, les molécules restent les mêmes mais peuvent être disposées différemment (ex : changement d’état, dissolution, diffusion d’un gaz, mélange…)
Visuellement, ce n’est pas toujours facile de différencier une transformation chimique d’une transformation physique : il peut y avoir un changement de couleur, un changement d’état sans qu’on ait besoin de refroidir ou de chauffer, une formation de bulles donc de gaz sans chauffage (sinon, cela peut être une simple ébullition qui est une transformation physique), une augmentation ou une diminution de température sans avoir besoin d’appareils de chauffage ou de refroidissement
Activité 1 bis : les notions de base sur la modélisation des transformations chimiques – 2ème partie.
Lors d’une transformation chimique, les atomes qui constituent les molécules des réactifs vont se réarranger pour former les molécules des produits : on retrouve donc les mêmes atomes, en même nombre, au début et à la fin de la transformation chimique. on dit qu’il y a conservation des éléments.
Par conséquent, il y a aussi conservation de la masse (comme le nombre de particules ne changent pas)
Pour modéliser une transformation chimique, on écrit une équation de réaction qui indique :
- les formules des réactifs
- les formules des produits
- les proportions de chaque espèce chimique
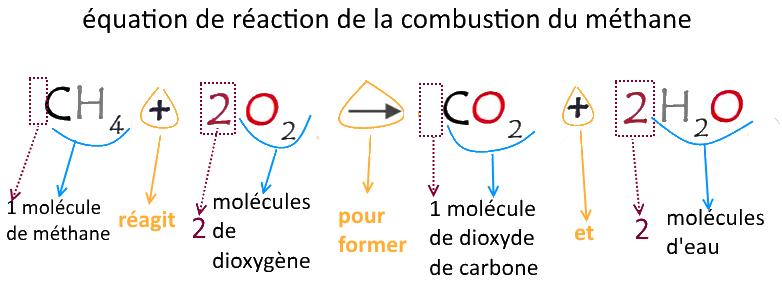
exemple : la combustion du méthane (regarder la vidéo jusqu’à 4min17 pour avoir les explications. La suite est pour plus tard…)
Activité 2 : les espèces chimiques existant dans la nature
- le courant électrique et la matière
Certains matériaux solides, comme les métaux, sont des conducteurs électriques et d’autres sont des isolants : cela s’explique par l’existence de petites particules appelées « électrons libres » qui peuvent se déplacer d’atomes en atomes (nous n’étudierons pas ce phénomène en classe mais pour les curieux, vous pouvez aller voir ici, « la nature du courant électrique »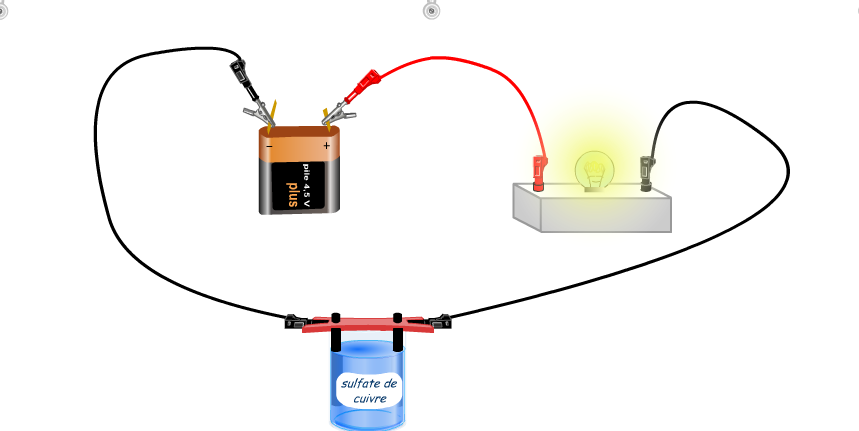
Voici une petite animation pour refaire de manière virtuelle l’expérience réalisée en classe (sans l’ampèremètre et avec une pile). merci au très bon site PCCL !
Déplacez les béchers avec la souris pour observer si le liquide est conducteur.
On s’aperçoit que les solutions qui ne contiennent que des molécules (eau déminéralisée, eau sucrée) sont des isolants.
Les autres contiennent une nouvelle sorte d’espèces chimiques : les ions.
Il est nécessaire que les ions soient dissous (c’est à dire, dispersés et mobiles dans un solvant) pour que la substance soit conductrice d’électricité.
Les ions sont des particules qui, lorsqu’ils peuvent se déplacer, permettent le passage du courant :
Une solution qui conduit le courant contient des ions.
- zoom sur les ions :
Les ions sont des particules électriquement chargées, soit positivement, soit négativement.
La formule d’un ion indique la composition et la charge électrique globale de l’ion.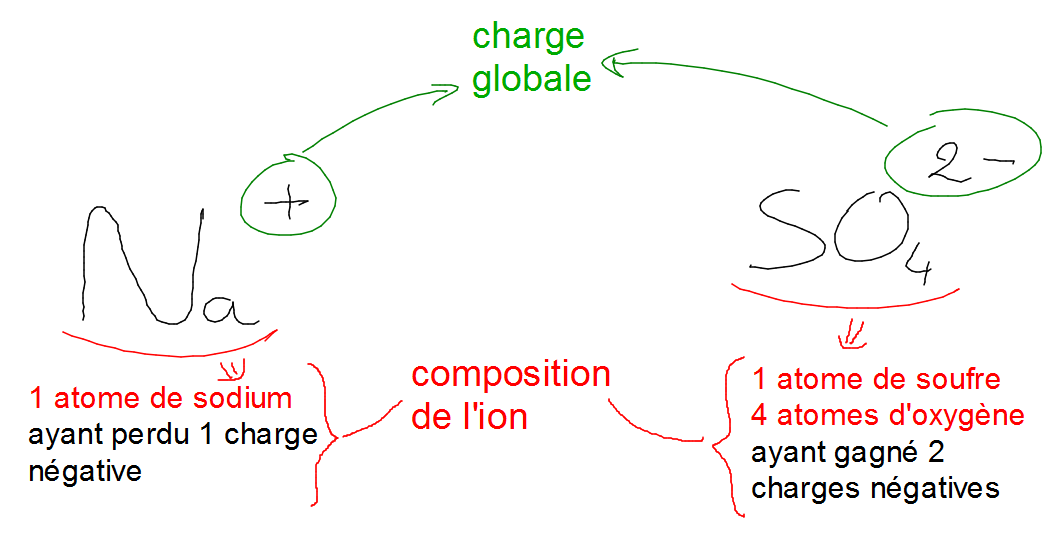
- zoom sur les solutions et les solides ioniques :
La formule d’une solution ionique ou d’un solide ionique indique la formule de l’ion positif et celle de l’ion négatif tout en respectant les proportions dans lesquels ils se trouvent.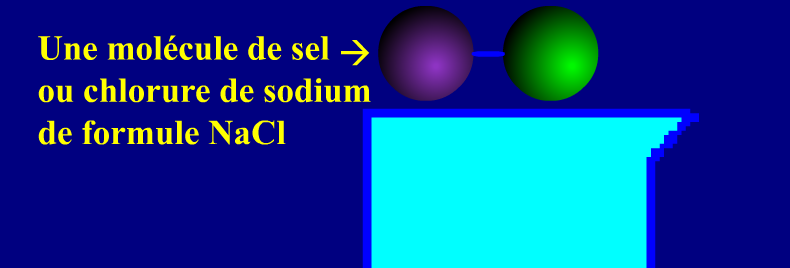
Dans un solide ionique, les ions sont liés entre eux mais lorsque le solide se dissous dans de l’eau par exemple, les deux ions vont se dissocier et se disperser entre les molécules d’eau : voici une animation pour expliquer comme le sel (ou chlorure de sodium) se dissous dans l’eau
Une solution ionique ou un solide ionique doit être électriquement neutre : le nombre de charges « + » apportées par les ions positifs doit compenser exactement le nombre de charges « – » apportées par les ions négatifs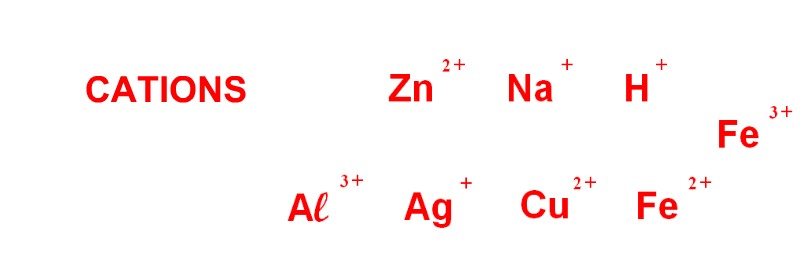
tu peux t’entrainer avec cet exercice interactif.
- la transformation d’un atome en un ion et vice versa :
Un ion provient d’un atome ou d’un groupe d’atome qui a perdu ou gagné des charges négatives .
L’atome et l’ion correspondant appartiennent au même élément chimique (voir tableau périodique).
Un atome qui a perdu des charges négatives devient un ion positif, aussi appelé cation.
Par exemple, l’atome de cuivre Cu peut devenir un ion cuivre Cu2+ quand il libère deux charges négatives (appelées électrons)
et un atome qui a gagné des charges négatives devient un ion négatif, aussi appelé anion.
Par exemple, l’atome de chlore Cl peut devenir un ion chlorure Cl– quand il capte une charge négative (appelées électrons)
Dans la vidéo ci-dessous, on utilise ce phénomène pour plaquer des boucles d’oreilles en or : la solution contient des ions or Au3+ .
Lorsque le courant circule, les ions or vont capter des électrons provenant du courant électrique et vont se transformer en atome d’or Au. Ceux-ci vont se déposer sur la boucle d’oreille et former petit à petit une fine couche appelée « plaquage ».
l’or n’est pas apparu comme par magie, il existait déjà sous forme ionique dans la solution utilisée!
retour au sommaire 3ème