le corrigé est en vert
les remarques sont en rouge
– TP –
Transformation chimique entre l’acide chlorhydrique et le fer.
problème : Sur l’étiquette d’une bouteille d’acide chlorhydrique, on peut lire qu’il ne faut pas mettre cet acide en contact avec les métaux. Pourquoi ?
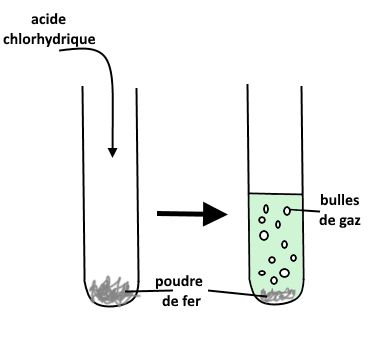
Expérience : On ajoute 2 mL d’acide chlorhydrique à un peu de poudre de fer dans un tube à essai. L’expérience est schématisée ci-dessous.
interprétation : pour comprendre ce qui se passe lors de cette transformation, il est nécessaire de réaliser des tests de reconnaissance permettant d’identifier les réactifs d’une part et les produits d’autres part.
Réalisation des tests de reconnaissance pour mettre en évidence les espèces chimiques présentes au début de la transformation.(identification des réactifs)

D’après le bilan1 p84 du livre, seul le fer est attiré par un aimant donc on peut déduire du résultat de l’expérience que la poudre, attirée par un aimant, est constituée de fer, de formule Fe.
Un test de reconnaissance permet d’identifier 1 seule substance à la fois. Il faut toujours se servir de l’observation et chercher dans les documents fournis quelle substance donne ce résultat. La réponse n’est pas à deviner : elle est écrite dans les documents et il n’y a qu’une seule substance possible à identifier pour chaque test.

le papier pH est devenu rouge au contact de l’acide.
D’après l’échelle de couleur, cela correspond à un pH de 1, soit très acide.
donc L’espèce chimique mis en évidence est l’ion hydrogène H+
Une valeur = un chiffre. Donc dire la valeur est acide n’est pas précis –> on attend une valeur chiffrée soit ici pH = 1
Une espèce chimique = un ion ou une molécule ou un atome → on attend le NOM précis d’une espèce chimique.
se rappeler : pH acide = présence d’ions H+

Dans le tube à essai, il se forme du précipité blanc.
D’après les tableaux des tests de reconnaissances, L’espèce chimique mis en évidence est l’ion chlorure Cl–
Se servir des légendes du schéma pour décrire l’observation.
Attention : Lorsqu’on utilise un test de reconnaissance, il faut faire la différence entre le détecteur (ici, le nitrate d’argent) et la substance identifiée (ici, l’ion chlorure)
Grâce à ces tests, on a mis en évidence les espèces chimiques qui existaient du début de l’expérience, c’est-à-dire les réactifs potentiels : toutes ces substances peuvent réagir.
Ici, ce sont : le fer Fe, l’ion chlorure Cl– et l’ion hdyrogène H+
Réalisation des tests de reconnaissance pour mettre en évidence les espèces chimiques présentes en fin de la transformation.(identification des produits et des espèces chimiques n’ayant pas réagi)
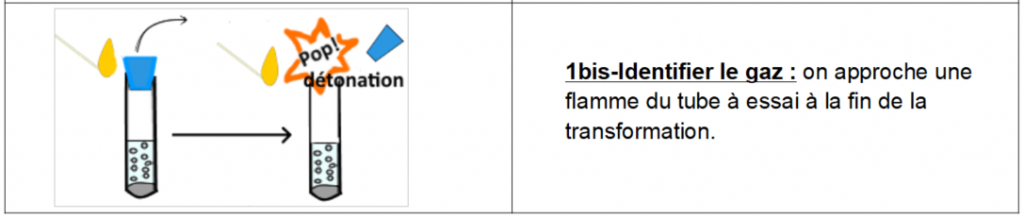
on observe que le gaz brûle avec une détonation quand on approche la flamme donc, d’après les tableaux des tests de reconnaissance, Le gaz est du dihydrogène, de formule H2.
Il n’existait pas au début de la transformation : il s’est donc formé = c’est un produit.
La conclusion pour un test de reconnaissance est soit « la substance n’a pas été identifiée » (test négatif) soit le nom de la substance (test positif).
UN TEST = UNE SUBSTANCE donc se servir de la fiche méthode (p429) pour trouver le nom → flamme + détonation = dihydrogène

Le papier pH est devenu vert clair au contact de la solution.
D’après l’échelle de couleur, cela correspond à un pH de 6, donc la solution est moins acide qu’au départ : on peut en déduire qu’il y a moins d’ion hydrogène H+ qu’au départ. Les ions hydrogène ont disparu donc ce sont des réactifs.
Attention : écrire pH et pas ph ou Ph ou PH

Dans le tube à essai, il se forme du précipité blanc.
D’après les tableaux des tests de reconnaissances, L’espèce chimique mis en évidence est l’ion chlorure Cl– .
Ces ions étaient déjà présents au début de la transformation: ils n’ont pas disparu donc ce ne sont pas des réactifs et ils ne sont pas apparus donc ce ne sont pas des produits. Ils sont justes présents.( on dit que ce sont des ions spectacteurs)

Dans le tube à essai, il se forme du précipité vert.
D’après les tableaux des tests de reconnaissances, L’espèce chimique mis en évidence est l’ion l’ion fer Fe2+.
Ces ions n’étaient pas présents en début de transformation : ils se sont donc formés = ce sont des produits.
Grâce à ces tests, on a mis en évidence les espèces chimiques qui existent à la fin de l’expérience,.
– Ceux qui sont apparus sont les produits de la transformation : ici ce sont les ions fer Fe2+. et le dihydrogène H2
– Ceux qui sont présents mais n’ont pas réagi, ici : l’ion chlorure Cl–
Conclusion
Bilan de la transformation : (uniquement les noms des réactifs et des produits)
fer + acide chlorhydrique –> dihydrogène + chlorure de fer
L’équation de la réaction s’écrit : (avec les formules et les coefficients indiquant les proportions de chaque réactif et de chaque produit)
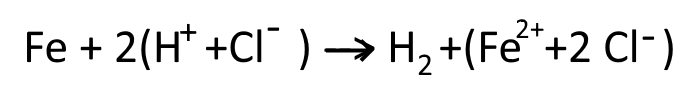
Vérifier la conservation des éléments : la conservation des éléments est vérifiée car on retrouve les mêmes éléments en même nombre chez les réactifs et les produits.

Vérifier la conservation des charges : la conservation des charges est vérifiée car la somme des charges des réactifs est égale à la somme des charges des produits

Dans cette transformation, les ions hydrogène se sont transformés en gaz dihdyrogène, explosif et le fer s’est transformé en ion ferII qui vont se dissoudre dans la solution.
En pratique, mettre de l’acide chlorhydrique dans un récipient en fer est dangereux car le récipient va se trouer peu à peu puisque le fer solide disparait donc de l’acide corrosif peut couler sur les mains des personnes qui touchent le récipient.
De plus, il se forme du gaz dihdyrogène qui est un gaz explosif.
Pour vous aider, la page du blog avec des informations sur ce TP : vidéo de l’expérience, expérience interactive
retour sommaire 3ème