La matière qui nous entoure est constituée de molécules : protéines, lipides, glucides sont les molécules que l’on peut trouver dans les aliments ; les gaz dioxygène, diazote, argon, dioxyde de carbone se retrouvent en plus ou moins grande quantité dans l’air; la kératine est une molécule que l’on peut retrouver dans les cheveux, dans la peau, …
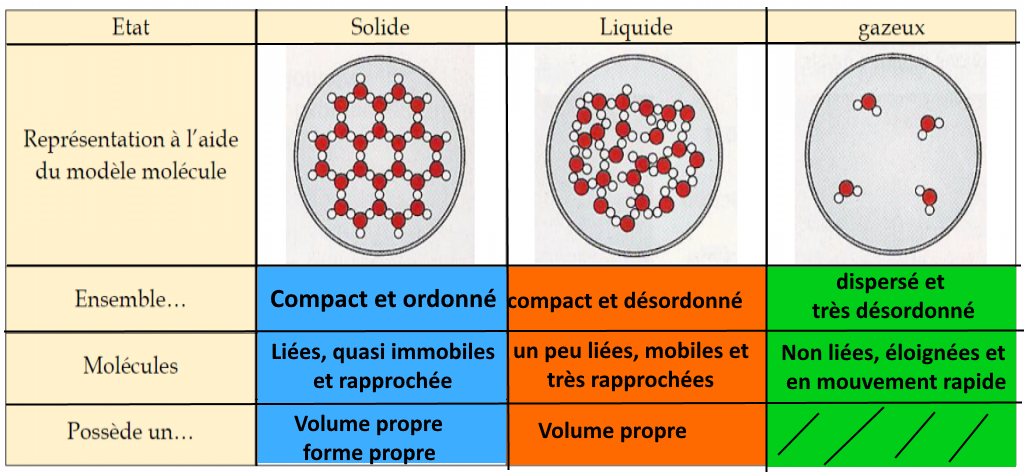
Rappel : La disposition des molécules change selon l’état de la matière mais les molécules restent les mêmes.
On peut rappeler qu’un corps pur n’est constitué que d’un seul type de molécules alors qu’un mélange contient plusieurs sortes de molécules différentes : ainsi, la molécule est la plus petite partie d’un corps pur.
La molécule est la plus petite partie d’un corps pur : les molécules d’un même corps pur sont toutes identiques (même forme, même volume, même masse). Elles sont séparées par du vide.
Une molécule est plus petite qu’une cellule. Elle n’est pas visible à l’œil nu, même avec un microscope optique.
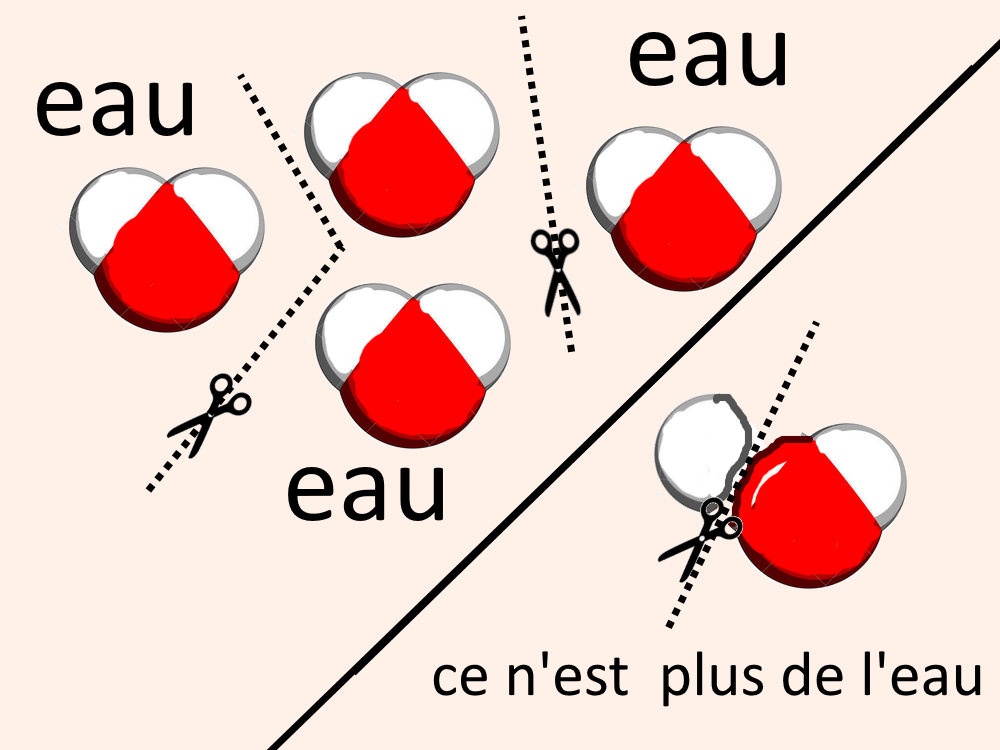
Ex : si on sépare 2 molécules d’eau, les 2 molécules séparées sont encore de l’eau.
si on coupe une molécule d’eau, les “morceaux” obtenus ne sont plus de l’eau.
exercices interactifs pour revoir les états de la matière et la différence entre corps pur et mélange au niveau moléculaire.
Mais de quoi est constituée une molécule ?
activité 1 : une molécule ? des atomes? c’est quoi la différence?
La matière est constituée de molécules, elles-mêmes constituées d’atomes : un atome est plus petit qu’une molécule.
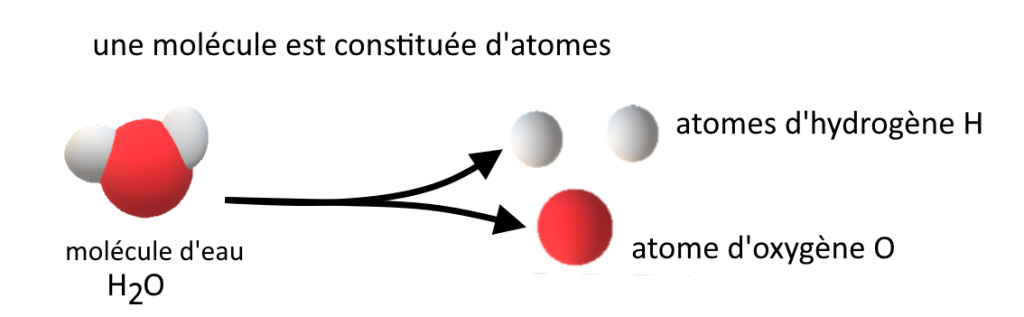
Une molécule est composée d’atomes liés entre eux.
Oui, mais un atome, alors, c’est quoi ?
Un atome est une particule extrêmement petite, invisible même avec un microscope optique.
Il y a environ 10 millions d’atomes dans 1 millimètre d’aluminium, (on l’étudiera de manière plus approfondie en troisième!) : il s’agit des briques qui permettent de construire toute la matière qui nous entoure.
Il existe une centaine d’atomes connus dans l’Univers (voir le tableau de Mendeleiv interactif de la cité des sciences pour les curieux)

voici une image d’atomes de carbone obtenu grâce à un microscope à effet tunnel : regarder l’échelle pour se rendre compte de la taille d’un atome (il y a environ 10 millions d’atomes de carbone sur la pointe d’une mine de critérium)
Pour étudier les transformations de la matière, il est nécessaire de pouvoir représenter à notre échelle ces atomes. On va donc utiliser des symboles (pour écrire des formules chimiques) et des modèles (pour faire des maquettes). Ce sont les mêmes partout dans le monde : c’est un peu comme un alphabet chimique que tout le monde peut comprendre où qu’il se trouve.




