Note : Les animations en Flash, trop vieilles, ne fonctionnent souvent plus sur la plupart des navigateurs – vous pouvez essayer avec internet explorer, cela fonctionne encore… Pour l’instant
Activité 1 : histoire de l’atome
Les premières personnes à avoir émis l’hypothèse de l’existence d’atomes étaient des philosophes (Leucippe et Démocrite, vers 400 avant J-C) mais ce n’est que près de 2000 ans plus tard que cette théorie sera reprise pour expliquer les proportions observées lors des transformations chimiques par John.Dalton en 1806.
Peu à peu, d’autres observations et découvertes permettent d’affiner le modèle de l’atome. On peut citer :
- En 1904 : Suite à la découverte de l’électron, particule chargée négativement, Joseph John Thomson explique que l’atome, électriquement neutre, contient des électrons, le reste de l’atome étant de la matière positive.
- En 1911, Ernest Rutherford découvre que des particules peuvent traverser des atomes : ils ne sont donc pas plein de matière, comme on l’imaginait mais plein de vide. La matière positive est condensée dans un noyau central, 100 000 fois plus petit que l’atome lui-même.
- La découverte en 1919 des protons et en 1935 des neutrons permettent d’expliquer le phénomène des isotopes (atomes du même élément, possédant les mêmes caractéristiques chimiques mais pouvant avoir des propriétés physiques ou radioactives différentes – voir l’animation en anglais ici)
- puis dans les années suivantes, une meilleure représentation du nuage électronique.
Cette animation permet de visualiser les différentes étapes de l’histoire du modèle atomique (ne pas oublier de cliquer sur « commentaires » pour voir les légendes)- animation Flash (ne fonctionne pas toujours- en voie de disparition
activité 2 : la composition de l’atome
Un atome est constitué :
- de vide : à 99,999%
- d’un noyau central (de charge positive) composé de nucléons., c’est-à-dire de protons et de neutrons.
Un proton est une particule porteuse d’une charge positive.
Un neutron est une particule électriquement neutre.
La charge positive du noyau correspond au nombre de protons qu’il contient.
- d’un nuage électronique ( de charge négative) composé d’électrons.
Un électron est une particule porteuse d’une charge négative.
La charge négative du nuage correspond au nombre d’électrons qu’il contient.
Un atome est électriquement neutre car il contient autant de protons que d’électrons.
Un atome est caractérisé par le numéro atomique Z de l’élément correspondant, répertorié dans la classification périodique des éléments ( ou tableau de Mendeleiev ).
Le numéro atomique Z indique le nombre de protons que contient le noyau de l’atome.
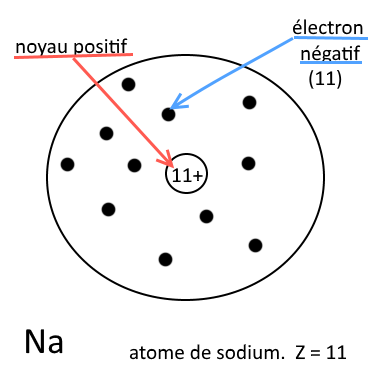
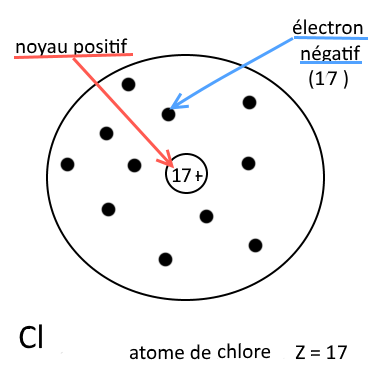
Exemple :
|
Atome de sodium (Z = 11) Il contient 11 protons et 11 électrons : il est neutre |
Atome de chlore (Z= 17) Il contient 17 protons et 17 électrons : il est neutre. |
Les dimensions de l’atome :
il existe des atomes plus ou moins gros mais leur dimensions sont tous du même ordre de grandeur :
- taille d’un atome : environ 10-10 mètre (soit environ 1000 milliards de milliards d’atomes dans 1 millimètre cube de matière)
- taille d’un noyau : environ 10-15 mètre (soit environ 100 000 fois plus petit que l’atome) → le volume de l’atome est constitué à 99,999999999 % de vide.
- masse du nuage électronique négligeable par rapport à la masse du noyau → 99,97 % de la masse de l’atome est concentrée dans le noyau.
activité 3 : la composition d’un ion monoatomique.
Un ion monoatomique provient d’un atome qui a perdu ou gagné un ou plusieurs électrons.
Un ion monoatomique est constitué :
- du même noyau que l’atome correspondant
- d’un nuage électronique avec un nombre différent d’électrons par rapport à l’atome.
Si l’ion est positif (on l’appelle cation), le nombre d’électrons est inférieur au nombre de protons : l’atome d’origine a perdu des électrons.
Si l’ion est négatif (on l’appelle anion), le nombre d’électrons est supérieur au nombre de protons : l’atome d’origine a gagné des électrons.
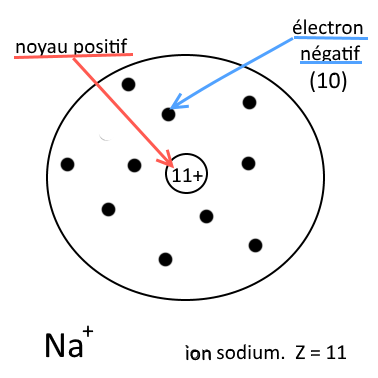
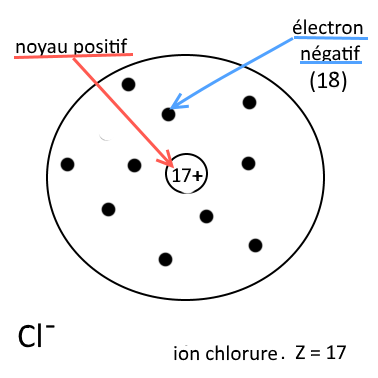
Exemple :
|
Ion sodium (Z = 11) Il contient 11 protons et 10 électrons : c’est un ion positif |
Ion chlorure (Z= 17) Il contient 17 protons et 18 électrons : c’est un ion négatif |
Un solide ou une solution ionique est toujours constitué d’un ion positif et d’un ion négatif : voici une animation (en Flash) permettant de visualiser l’échange des électrons entre l’atome de sodium et l’atome de chlore pour former l’ion sodium et l’ion chlorure. Et le même phénomène (toujours en Flash 🙁 ) expliqué à l’intérieur même des atomes…
Et le même phénomène (toujours en Flash 🙁 ) expliqué à l’intérieur même des atomes…
et maintenant un petit exercice (encore en Flash) pour voir si vous êtes au point !